QuantiNova Probe PCR Kit (100)
Cat. No. / ID: 208252
特点
- 带有内置可视化对照的精确反应配制
- 精确且稳健地检测低至一个拷贝的靶标
- 新颖的热启动机制带来无与伦比的特异性
- 在 1 管反应中灵敏地检测多达 5 个靶标
- 30°C 下反应稳定性长达 100 小时,可实现灵活的工作流程
产品详情
QuantiNova SYBR Green PCR Kit(SYBR qPCR 试剂盒)具有更高的特异性、灵敏度、速度和过程安全性,为基于 SYBR Green 的 qPCR 树立了新的标准。新颖的热启动机制显著提高了 Real-time PCR 的特异性,经过优化的化学方法可在任何 Real-time PCR 定量 PCR 仪上从 cDNA 或 gDNA 中产生精确的定量结果,甚至可检测到单个靶标拷贝。最后,内置的可视化指示对照可确保正确移液。
使用 QuantiNova Probe PCR Kit(探针法 qPCR 试剂盒)可避免在较低温度下因非特异性扩增而对结果造成不良影响。该试剂盒基于新颖的抗体介导热启动机制,提高了探针法 Real-time PCR 的特异性和效率,可在各种 Real-time 定量 PCR 仪上进行准确的单重或双重 cDNA 或 gDNA 分析。反应体系可在室温下保持极度稳定达 100 小时,而无需使用任何冷却剂,这一额外便利性使该试剂盒非常适于处理高通量样本或采用自动化工作流程。内置的示踪系统能够直观识别移液是否正确,让您高枕无忧;即使靶标量很低,也能进行极其灵敏的检测,确保每次都能获得可靠的 qPCR 结果。
QuantiNova Multiplex PCR Kit(多重 qPCR 试剂盒)能通过多重 Real-time PCR 或两步法 RT-PCR,在一管反应中快速而又可靠地定量多达 5 个 cDNA 或 gDNA 靶标。Q-bond 技术和经过优化的预混液可在 1 小时内实现超快的多重 Real-time PCR。即用型 4x 预混液中独特的热启动和 PCR 缓冲液系统相结合,可确保无需优化便可在任何实时定量 PCR 仪上进行高灵敏度的 qPCR,还可在室温下提供自动反应体系配制的选项。内置的示踪系统能够直观的识别移液是否正确,有助于防止人为失误,与用于 cDNA 合成的 QuantiNova Reverse Transcription Kit 结合使用,可加入 QuantiNova Internal Control RNA 以监测逆转录和 qPCR 是否成功。
绩效
想首次试用 QuantiNova SYBR Green PCR Kit 吗?获取试用试剂盒报价。
想首次试用 QuantiNova Probe PCR Kit 吗?获取试用试剂盒报价。
想首次试用 QuantiNova Multiplex PCR Kit 吗?获取试用试剂盒报价
内置可视化对照,可实现准确的反应配制
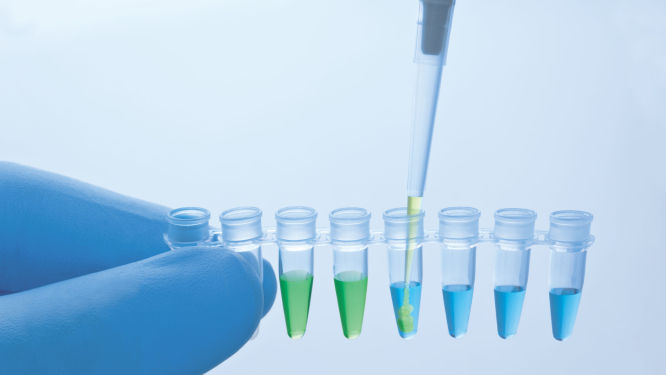
QuantiNova PCR Kit 随附的预混液中包含惰性蓝色染料,该染料不会干扰 Real-time PCR,但可提高反应管或孔的可见性。QuantiNova Yellow Template Dilution Buffer 中包含惰性黄色染料。在 QuantiNova Yellow Template Dilution Buffer 中稀释模板核酸并加入到预混液中时,溶液的颜色会从蓝色变为绿色(请参阅图“ 内置移液对照可显示准确的反应配制”),从而直观地显示每个反应的配制是否正确。
QuantiNova SYBR Green PCR Kit
QuantiNova SYBR Green PCR Kit 灵敏度高,即使是单个靶标拷贝也能准确而又稳健地检测到(请参阅图“ 单拷贝靶标的检测稳健而又灵敏”)。即使在超快速循环条件下,也能实现这种极高的灵敏度。
QuantiNova SYBR Green PCR Kit 可用于多种模板量。该 SYBR real-time PCR 试剂盒的性能已在覆盖 8 个数量级(从 100 ng 到 10 fg cDNA)的动态范围内进行了测试,无论使用哪种仪器,定量都准确、可靠(请参阅图“ 宽动态范围内的精确定量”)。
QuantiNova 化学试剂具有严格的特异性和优异的灵敏度,可在 QIAGEN Rotor-Gene Q 上产生最佳结果,但也可用于任何 Real-time PCR 仪,不受格式、快速循环能力和参比荧光染料需求的限制。QuantiNova SYBR Green PCR Kit 附带的 ROX 只需视需求添加到预混液中。使用 Rotor-Gene Q、Agilent Technologies Mx3005P、Applied Biosystems 7900 HT Fast、ViiA 7、StepOnePlus 和 7500 Fast、Roche LightCycler 480 和 Bio-Rad CFX96 获得的扩增和定量结果始终可靠而又灵敏。
与其他 SYBR Green PCR 试剂盒相比,QuantiNova SYBR Green PCR Kit 能提供更优质的结果。事实证明,无论循环条件或仪器如何,QuantiNova 化学试剂都能产生更低的 CT 值、更高的可重现性和更高的反应效率。
QuantiNova Yellow Template Dilution Buffer 可让您放心地进行反应配制,但其对于使用 QuantiNova SYBR Green PCR Kit 获得更优质的结果并不是必需的。QuantiNova 化学试剂设计灵活,以便可融入任何既有的工作流程。因此,使用您感兴趣的扩增靶标以及您选择的仪器和稀释缓冲液,就能获得最佳性能。
QuantiNova Probe PCR Kit
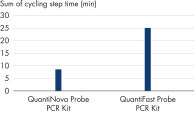
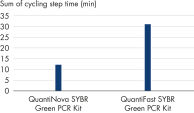
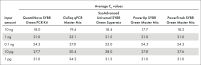
该探针法 Real-time PCR 试剂盒的 Real-time PCR 预混液可在 30°C 下存放长达 100 小时而不会影响后续反应的性能。优异的稳定性——即便在室温不使用冷却剂的情况下,长时间存放后仍保持性能的稳定性——使得 QuantiNova Probe PCR Kit 成为高通量反应体系构建及孔板堆叠处理时的理想选择(请参阅表“存放对反应稳定性的影响”)。
| 平均 CT 值 | ||||
| QuantiNova Probe PCR Kit | 来自供应商 L 的探针 PCR 试剂盒 | |||
| 量 (ng) | 0 h | 100 h | 0 h | 100 h |
| 10 | 24.37 | 24.49 | 24.35 | 27.49 |
| 1 | 27.78 | 27.90 | 27.77 | 30.97 |
| 0.1 | 31.16 | 30.98 | 31.37 | 34.48 |
| 无模板对照 | 未检测到 | 未检测到 | 未检测到 | 未检测到 |
在 30°C 下存放 100 小时前后 CT 值的比较。将包括预混液、模板 cDNA、引物和 TNF 探针在内的 Real-time PCR 体系在 30°C 下孵育 100 小时后,与新鲜制备的反应一起进行 Real-time PCR。测试了 3 种不同模板量的三重反应。与供应商 L 的探针 PCR 试剂盒相比,QuantiNova Probe PCR Kit 获得的 CT 值与样本在 30°C 下长时间存放后没有变化。
QuantiNova Probe PCR Kit 灵敏度高,即使是单个靶标拷贝也能准确而又稳健地检测到(请参阅图“ 单拷贝靶标的检测稳健而又灵敏”)。这些试剂盒附带的专用预混液可在单管反应中准确定量丰度差异很大的 2 个靶标。这可节省时间和金钱,降低所需的样本材料用量。此外,获得的双重 PCR 与单重 PCR 数据相当。
QIAGEN 独有的、经过充分验证的缓冲液技术与新型 QuantiNova DNA Polymerase、QuantiNova Antibody 和 QuantiNova Guard 的独特结合,确保了即使是高难度的 Real-time PCR 检测,也能首次尝试即获得成功,而无需进行高成本而又耗时的优化(请参阅图“ 在高难度检测中获得高质量结果”)。
QuantiNova Probe PCR Kit 可用于任何实时定量 PCR 仪。ROX 以独立的单管形式提供,如果使用需要将 ROX 用作参比荧光染料的定量 PCR 仪,则可进行添加。在灵敏度、可重现性和效率方面,该试剂盒可在不同的定量 PCR 仪之间保持高度一致的结果。尽管不同定量 PCR 仪的快速循环能力不同,导致循环程序条件不同,但结果仍能保持一致。
QuantiNova Multiplex PCR Kit
QuantiNova Multiplex PCR Kit 附带的专用预混液可快速设置多重反应,并在第一次尝试时就能获得成功的结果,提供的多重 PCR 数据可与单重 PCR 数据相媲美。高浓度 4x 预混液最多可容纳 800 ng 模板投入,即使在多达 5 重的反应中也能确保出色的灵敏度。该试剂盒能清楚地区分模板量的微小差异,并能对丰度差异很大的靶标进行精确定量。
新颖的抗体介导热启动机制确保了出色的特异性,并允许在室温下进行反应配制,非常适合自动化程序。专门开发的快速 PCR 缓冲液含有添加剂 Q-Bond,可显著缩短退火和延伸时间,从而在不到一小时内完成多重 qPCR。可视化移液对照有助于防止人为失误误并提高过程安全性,尤其是在与 QuantiNova Reverse Transcription Kit 中提供的 Internal Control RNA 结合使用进行两步法定量 RT-PCR 时。
QuantiNova Multiplex PCR Kit 通过使用超快和过程内受控的多重 qPCR,从有限的样本材料中获得更多信息,从而提高工作流程的效率。
查看图表
原理
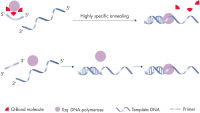
QuantiNova PCR Kit 由于采用抗体介导的新型热启动机制(请参阅图“ 新型 QuantiNova 热启动机制的原理”),能以最高的特异性进行 cDNA 或 gDNA 分析。在低温下,QuantiNova DNA Polymerase 在 QuantiNova Antibody 和 QuantiNova Guard(一款具有复合物稳定化作用的新型添加剂)的作用下保持在失活状态。这提高了热启动的严格性并防止非特异性退火引物的延伸及引物二聚体的形成。在温度升高到 95°C 的两分钟内,QuantiNova Antibody 和 QuantiNova Guard 将发生变性,QuantiNova DNA Polymerase 将被激活,从而启动扩增。
此外,QuantiNova 化学试剂还具有精简工作流程而又不会丧失 PCR 灵敏度和效率的特性。预混液和 QuantiNova Yellow Dilution Buffer 中的惰性染料充当每个反应是否已正确配制的可视化指示剂。蓝色的预混液提高了反应容器中内容物的可见性,加入经 QuantiNova Yellow Dilution Buffer 稀释的模板核酸后,其颜色会变成绿色(请参阅图“ 内置移液对照可显示准确的反应配制”)。QuantiNova SYBR PCR Kit 所含 PCR 缓冲液的独特配方增强了热启动机制的严格性,缩短了循环步骤,从而加快了 PCR 的完成速度,因而可提高通量。
QuantiTect Multiplex PCR Kit 在标准和快速定量 PCR 仪上无需优化即可在宽动态范围内快速提供高灵敏度的结果。专门开发的快速 PCR 缓冲液含有添加剂 Q-Bond,可显著缩短退火和延伸时间(请参阅图“ 快速引物退火”)。
在同一而非独立反应中扩增对照和靶标基因可尽量减少操作错误,从而提高基因定量的可靠性。此外,还可纳入 QuantiNova Reverse Transcription Kit 中提供的用于两步法定量 RT-PCR 的 Internal Control RNA,以监测逆转录和 qPCR 是否成功。
QuantiNova Multiplex PCR Buffer 含有 K+ 和 NH4+ 离子的平衡组合以及独特的 Synthetic Factor MP,它们共同促进引物和探针稳定高效地退火到核酸模板,从而实现高 PCR 效率(请参阅图“ 独特的多重 PCR 缓冲液可促进稳定高效的退火”)。
QuantiNova Multiplex PCR Kit 预混液可在 2–8°C 下存放长达 12 个月,而且反应体系在室温下也非常稳定,因此可通过自动化程序提高效率和准确性。
查看图表
程序
QuantiNova PCR Kit 包含即用型预混液,无需优化反应和循环条件。只需将模板 gDNA 或 cDNA 和引物(基于 SYBR Green 的检测)或模板 gDNA 或 cDNA、引物和探针(探针式检测)添加到预混液中,然后按照手册中的方案操作,即可在任何实时定量 PCR 仪上快速获得可靠的结果。ROX 参比荧光染料装在独立的小管中,染料浓度可根据所使用的定量 PCR 仪类型进行调整。因此,QuantiNova PCR Kit 几乎可在任何实时定量 PCR 仪上使用,不受格式或循环条件的限制。由于 ROX 浓度经过优化,即使是低拷贝数也能通过自动数据分析检测出来。
QuantiNova Multiplex PCR Kit 包含即用型预混液,无需优化反应和循环条件。只需将最多 800 ng 模板 DNA 和引物-探针组合加入预混液中,然后按照手册中的方案操作,即可在任何实时定量 PCR 仪上快速获得快速可靠的结果。试剂盒提供独立单管包装的 ROX 参比荧光染料,以便根据仪器需求调整适当的 ROX 浓度。
为了在实时两步法 RT-PCR 中获得最佳结果,我们建议使用 QuantiNova Reverse Transcription Kit 合成 cDNA,该试剂盒可在短短 20 分钟内快速合成 cDNA,并集成了去除基因组 DNA 污染功能。此外,该试剂盒还提供 QuantiNova Internal Control RNA,可对逆转录和 qPCR 是否成功进行过程中监测。
为了精简工作流程,我们建议将 QuantiNova 试剂盒与我们预先设计的 QuantiNova Real-time PCR assay 或 panel 结合使用。这些试剂盒可精确定量 mRNA 或较长非编码 RNA 转录物,无论其丰度如何。您可以从多种预先设计的人、小鼠和大鼠引物集中进行选择,也可以使用我们的高级设计工具定制您自己的 assay 和 panel。
我们的 QuantiNova LNA PCR 和 QuantiNova LNA Probe PCR Assay 利用 LNA 技术提高了灵敏度,从而实现无偏基因表达谱和更快地获得科学见解。
应用
QuantiNova SYBR Green PCR Kit 可用于在任何实时定量 PCR 环仪上对 cDNA 靶标进行基于 SYBR Green 的基因表达分析以及定量 gDNA 分析。这包括来自 Applied Biosystems、Bio-Rad、Cepheid、Eppendorf、LIFE Technologies、Roche 和 Agilent 的仪器,以及 Rotor-Gene Q。
QuantiNova Probe PCR Kit 可用于在任何实时定量 PCR 仪上对 cDNA 靶标进行探针法基因表达分析以及定量 gDNA 分析。这包括来自 Applied Biosystems、Bio-Rad、Cepheid、Eppendorf、Roche 和 Agilent 的仪器。
QuantiNova Multiplex PCR Kit 可用于在任何实时定量 PCR 仪上对 cDNA 或 gDNA 靶标进行多重基因表达分析。为充分发挥多重分析的优势,我们推荐使用具有高达 5 重能力的仪器,如 Rotor-Gene Q。
辅助数据和图表
内置移液对照可显示准确的反应设置。