Products
특징
- 아데노 연관 바이러스 용해를 위한 하나의 키트와 하나의 프로토콜 솔루션으로 현재 작업 흐름의 표준화 및 품질 관리(Quality Control, QC)를 지원
- 여러 혈청형(예: 아데노 연관 바이러스 혈청형)에 대한 바이러스 역가를 일관되고 재현성 있게 측정
- QIAcuity Cell and Gene Therapy (CGT) dPCR Assays와 결합된 완전한 작업 흐름 및 QIAcuity Digital PCR System에서 아데노 연관 바이러스 역가를 정확하게 측정
제품 세부 정보
아데노 관련 바이러스는 유전자 치료 응용 분야에서 널리 사용되는 바이러스 벡터입니다. 그러나 바이러스 벡터의 생성 및 정제 과정의 경우, 임상 연구 또는 환자 치료 중에 안전하고 신뢰할 수 있는 투여를 가능하게 하려면 정밀한 품질 관리가 필요합니다. 벡터 역가를 정확하게 정량화하고 오염을 검출하는 능력은 안전하고 효과적인 아데노 연관 바이러스 기반 유전자 치료의 핵심입니다.
당사는 100회 또는 1,000회 반응 시약이 포함된 CGT Viral Vector Lysis Kit를 도입하여 이제 바이러스 벡터 용해부터 정확하고 정밀한 바이러스 역가 측정 방법까지 최적화되고 표준화된 작업 흐름을 갖추게 되었습니다. 이 키트는 아데노바이러스와도 사용 가능합니다.
성능
당사는 아데노 연관 바이러스 용해 수행부터 세포 용해물의 바이러스 역가 정량화까지 완전한 작업 흐름을 제공합니다. 개선된 조성의 CGT Viral Vector Lysis Kit는 최종 역가를 일관되고 안정적이며 정확하게 측정할 수 있습니다. 이 키트는 QIAcuity Cell and Gene Therapy dPCR Assays, QIAcuity Digital PCR System, QIAcuity Probe PCR Kit, QIAcuity Nanoplate 8.5K와 함께 사용하며, qPCR에 필적하는 엔드 투 엔드(end-to-end) dPCR 작업 흐름을 제공하지만, 검체 내 아데노 연관 바이러스 벡터 게놈 복제수의 절대적인 정량화를 실현합니다.
원리
아데노 연관 바이러스 용해를 위한 올인원 솔루션을 제공합니다.
- 훨씬 간편한 표준 작동 절차(Standard Operating Procedure, SOP) 구현 및 품질 관리(Quality Control, QC)를 통한 아데노 연관 바이러스 용해의 표준화
- 일관된 역가 정량화
- QIAcuity Nanoplate 8.5k에서 2.5copies/µl~15,000copies/µl의 광범위한 검출 범위
- 실험자와 분석 간 10% CV 미만의 견고성
CGT Viral Vector Lysis Kit는 QIAcuity Cell and Gene Therapy dPCR Assays 및 QIAcuity 기기에서 싱글플렉스 또는 멀티플렉스 반응을 실행하는 QIAcuity Probe PCR Kit와 함께 이제 완전한 바이러스 역가 작업 흐름을 제공합니다.
나노플레이트에서의 dPCR 반응 원리는 여기에 설명되어 있습니다.
절차
CGT Viral Vector Lysis Kit는 아데노 연관 바이러스 벡터를 위한 100회 또는 1,000회 반응용 시약 두 상자와 함께 제공됩니다. 이 키트는 AAV2, AAV5, AAV6, AAV8, AAV9의 용해에 적합합니다. 이 용해물은 QIAcuity Probe PCR Kit와 함께 QIAcuity Cell and Gene Therapy dPCR Assays에 최적화되어 있습니다. 이러한 분석은 바이러스 역가 및 벡터 복제수 측정을 포함하여 싱글플렉스는 물론 멀티플렉스 세포 및 유전자 치료 응용 분야를 지원합니다. 이 키트에는 아래 Resources(리소스) 섹션에 포함된 프로토콜 내에 명시된 제한 효소(예: Hpall)가 포함되어 있지 않습니다.
응용 분야
CGT Viral Vector Lysis Kit는 바이러스 벡터 게놈 역가 및 벡터 복제수 측정을 포함한 다양한 응용 분야에서 아데노 연관 바이러스 및 아데노바이러스를 용해하는 데 사용됩니다.
지원되는 데이터 및 수치
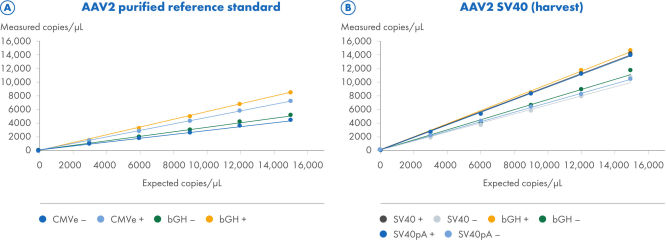
ITR digestion improves the quantification of ITR and non-ITR targets
Two AAV2 samples were processed using the CGT Viral Vector Lysis Kit and quantified using the QIAcuity Digital PCR instrument with 8.5k Nanoplates and the CGT dPCR Assays. The CGT dPCR Assays were run in triplex reactions in the FAM, HEX and Cy5 channels. The samples were serially diluted in 6 steps from 15,000 copies/µL down to 2.5 copies/µL with an R2=1.0 on 8.5k Nanoplates (A, B). Each dilution was measured in technical triplicates. Quantifications were performed with (+) and without (–) restriction digest of the ITR regions. (A) For the titration of a purified AAV2 reference standard sample, the CGT dPCR assays targeting the CMV enhancer bGH polyA regions were used. The expected copies are based on an ITR estimate determined by qPCR measurements from the reference standard supplier and not directly comparable to dPCR measurements. (B) For the titration of the AAV2-SV40 harvest sample, the CGT dPCR Assays targeting the SV40 promoter, SV40 polyA and bGH polyA regions were used.