✓ オンライン注文による24時間年中無休の自動処理システム
✓ 知識豊富で専門的な製品&テクニカルサポート
✓ 迅速で信頼性の高い(再)注文
QIAEX II Gel Extraction Kit (150)
Cat. No. / ID: 20021
✓ オンライン注文による24時間年中無休の自動処理システム
✓ 知識豊富で専門的な製品&テクニカルサポート
✓ 迅速で信頼性の高い(再)注文
特徴
- 40 bp ~ 50 kbのDNAの効率的な抽出
- TAEまたはTBEアガロースゲルおよびポリアクリルアミドゲルからのゲル抽出
- その後の反応を妨げるヨウ化ナトリウムは使用しない
- 大きなDNAフラグメントの剪断
製品詳細
QIAEX IIシステムは、カオトロピック塩の存在下でDNAフラグメントが結合するシリカ粒子の懸濁液です。QIAEX II Suspensionを溶液または可溶化アガロースゲルスライスに添加すると、DNAに結合します。短時間の遠心分離操作により粒子が回収され、洗浄された後、40 bp ~ 50 kbのDNAがTrisバッファーまたは水で溶出されます。
パフォーマンス
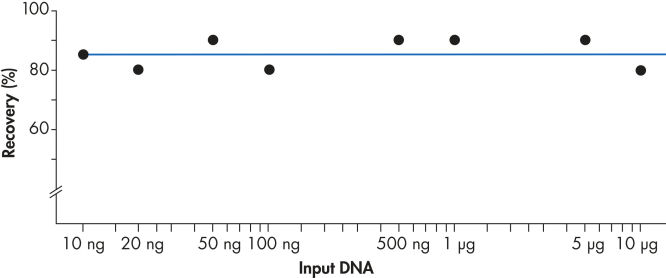
QIAEX IIシステムを使用すると、10 ng ~ 10 µgのDNAが効率的に回収されます( 「一貫した回収」の図を参照)。この用途の広い、ゲルフラグメントのバッチ精製用手順は容易にスケールアップして、30 µl QIAEX Ii懸濁液を使用して15 µgまで結合することができます。
QIAEX Iiシステムは、60–95%のDNAフラグメント(40 bp – 50 kb)を精製するためのシリカ粒子の懸濁液です。10 µl のQIAEX II suspensionで、最大5 µgのDNAに結合し、20 µlで溶出されます。
サイズに応じた回収
| DNAサイズ | 回収率、%* |
|---|---|
| 44 bp | 75 |
| 75 bp | 75 |
| 500 bp | 95 |
| 7.5 kb | 85 |
| 23.5 kb | 75 |
| 48.5 kb | 60 |
図参照
原理
QIAEX IIシステムによるDNAフラグメントの精製は、アガロースの可溶化とカオトロピック塩の存在下でのQIAEX IIシリカゲル粒子上への核酸の選択的吸着に基づいています。QIAEX IIは、フェノール抽出やエタノール沈殿を用いることなく、DNAを塩、アガロース、ポリアクリルアミド、色素、タンパク質およびヌクレオチドからDNAを分離します。QIAEX IIは、TAEまたはTBEバッファーのいずれかで、あらゆるタイプのアガロースに対して効果的です。
QIAEX II粒子は、ゲル抽出のために使われます。大きなDNAフラグメントに対して剪断をすることなく効率的に回収します。最適化されたバッファーにより、ヨウ化ナトリウムなしでDNAの回収ができます。ヨウ化ナトリウムはDNAサンプルから除去することができず、後に続く反応に影響するおそれがあるためです。
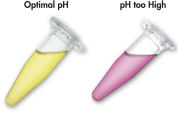
QIAEX IIシステムと共に使用する可溶化および結合バッファーには、ユニークなpH指示薬が含まれています。単純な色の変化で、結合混合液のpHが、QIAEX IIシリカ粒子へのDNAの効率的な吸着に最適かどうかを判断することができます。( 「pH指示薬色素」の図を参照)この色素は、さらに結合混合液内の可溶化しないアガロースを容易に可視化することもでき、最大の収量を得るために完全な可溶化を保証します。
可溶化および結合バッファー中のpH指示薬色素により、DNA吸着の最適なpH(pH ≤7.5)を目視で簡単に決定することができます。アガロースゲル電気泳動バッファーを繰り返し使用したり、バッファーの調製が間違っていたりすると、binding-mixtureのpHが不適切になるおそれがあります。この場合、pHは、10 µlの3 M 酢酸ナトリウム、pH 5.0を追加することで容易に調整できます。
図参照
操作手順
QIAEX IIシリカゲル粒子は、可溶化したゲルスライスに添加され、短い遠心分離のステップにより回収されます。( 「QIAEX IIの操作手順」のフローチャートを参照)。洗浄後、純粋なDNAフラグメントは20 µlのTrisバッファーまたは水に溶出します。
QIAEX IIシステムは、結合および洗浄バッファーや総合ハンドブックと共にQIAEX II懸濁液を提供します。アガロースゲル、溶液、ポリアクリルアミドゲルからのDNA精製のためのプロトコールが提供されています。
図参照
アプリケーション
QIAEX IIシステムで精製されたDNAは、直接に以下を含むほとんどのアプリケーションに使用できます。
- 制限酵素処理
- Labeling
- ライゲーション
- PCR
| 特徴 | 仕様 |
|---|---|
| 結合容量 | 5 µg/10 µl |
| 溶出量 | 20 µl |
| フォーマット | チューブ |
| フラグメントサイズ | 40 bp – 50 kb |
| 処理 | 手動 |
| 回収:オリゴヌクレオチドdsDNA | 回収:dsDNAフラグメント |
| 除去<10mers 17–40mersダイターミネータータンパク質 | 除去<40mers |
| サンプルタイプ:アプリケーション | DNA:PCR反応 |
| 技術 | シリカテクノロジー |
裏付けデータと数値
一貫した回収。