✓ Traitement automatique des commandes en ligne 24 h/24 7 j/7
✓ Assistance technique et produits pertinente et professionnelle
✓ Commande (ou réapprovisionnement) rapide et fiable
E. coli resDNA Quant Standard Kit
Cat. No. / ID: 250221
✓ Traitement automatique des commandes en ligne 24 h/24 7 j/7
✓ Assistance technique et produits pertinente et professionnelle
✓ Commande (ou réapprovisionnement) rapide et fiable
Caractéristiques
- Master Mix préalablement mélangé avec contrôles pour la mise en place et la détection simplifiées de l’ADN de cellule hôte
- Permet la détection de précision de l’ADN de cellule hôte résiduel à partir de cellules E.coli, CHO et HEK293 à des taux infimes en femtogrammes
- Dosage cible multicopies capable de détecter et quantifier un ADN de cellule hôte hautement fragmenté
- Permet la détection de l’ADN de cellule hôte dans des échantillons extraits et non extraits
Détails produit
La contamination de l’ADN de cellule hôte dans des produits tels que les vaccins, les médicaments ou d’autres substances biopharmaceutiques fait courir d’importants risques sanitaires. Ainsi, les limites de sécurité sont scrupuleusement régulées par des agences telles que la FDA aux États-Unis et l’OMS. Des directives claires pour les limites supérieures de l’ADN résiduel sont définies en fonction de la nature de l’administration médicamenteuse, de l’infectivité et de l’oncogénicité de l’ADN cellulaire contaminant. Par exemple, l’administration parentérale d’ADN cellulaire non oncogène doit être limitée à 10 ng/dose et une longueur maximale de 200 pb, alors que l’OMS recommande moins de 100 µg/dose d’ADN résiduel pour des vaccins par voie orale.
La détection et l’extraction de ces contaminations dans les produits fabriqués nécessitent des mesures particulièrement sensibles et précises des quantités extrêmement faibles d’ADN de cellule hôte spécifique présent dans les produits.
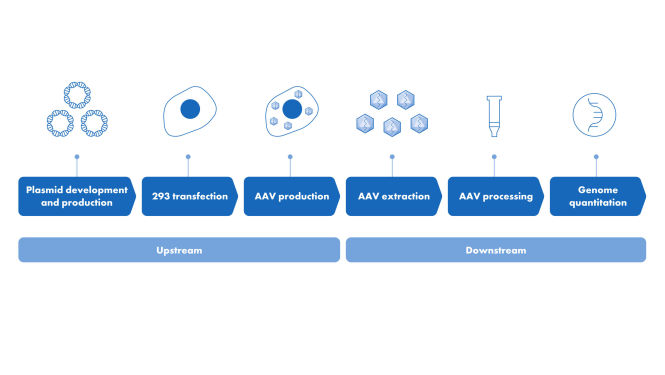
La PCR numérique est la méthode privilégiée de détection pour la quantification de l’ADN résiduel, en raison de sa sensibilité et de sa précision inégalées, notamment sur des traces infimes de contamination, par rapport aux autres méthodes de détection telles que la qPCR. Les QIAcuity Residual DNA Quantification Kits permettent la détection de précision de l’ADN de cellule hôte d’Escherichia coli (E.coli), de cellules ovariennes de hamster chinois (Chinese Hamster Ovary cell, CHO) et de cellules 293 de rein embryonnaire humain (Human Embryonic Kidney 293 cells, HEK293).
Performances
Les QIAcuity Residual DNA Quantification Kits donnent des résultats de quantification de l’ADN résiduel (ADNres) de CHO, E. coli et HEK293 avec ou sans extraction, même en présence de contaminants de PCR et d’autres réactifs inhibiteurs. Il s’agit de dosages cibles multicopies qui déterminent avec précision l’ADN de cellule hôte résiduel hautement fragmenté.
| Dosage | Nombre de copies cibles | Taille de l’amplicon | Facteur de conversion cp/µl en fg/µl |
|---|---|---|---|
| QIAcuity E.coli resDNA Quant Kit | 7 | < 200 | 0,35 |
| QIAcuity CHO resDNA Quant Kit | ~ 1 million, non défini (élément répété) | < 100 | 0,28 |
| QIAcuity HEK293 resDNA Quant Kit | ~ 1 million, non défini (élément répété) | < 100 | 1,54 |
Le QIAcuity E.coli resDNA Quant Kit détecte 5 fg d’ADN résiduel dans une seule réaction
| Quantité de chargement par réaction (fg/réaction) | E.coli standard (copies/µl) | Contrôle interne (copies/µl)* |
|---|---|---|
| 50000 | 2949,7 | 99,9 |
| 5000 | 291,6 | 91,7 |
| 500 | 27,6 | 91,4 |
| 50 | 2,8 | 93,2 |
| 25 | 1,46 | 92,5 |
| 5 | 0,45 | 90,6 |
| NTC | 0 | 98,9 |
*100 copies/µl prévues pour le contrôle interne
La PCR numérique offre une meilleure sensibilité de détection avec une quantité de matrice inférieure par rapport à la qPCR et permet donc une application plus fiable.
Le QIAcuity CHO resDNA Quant Kit détecte 5 fg d’ADN résiduel dans une seule réaction
| Quantité de chargement par réaction (fg/réaction) | CHO standard (copies/µl) | Contrôle interne (copies/µl)* |
|---|---|---|
| 50000 | 4 939,3 | 108,7 |
| 5000 | 508,3 | 104,9 |
| 500 | 50,2 | 97,6 |
| 50 | 4,7 | 99,5 |
| 25 | 2,6 | 101,3 |
| 5 | 0,6 | 100,4 |
| NTC | 0 | 104,7 |
*100 copies/µl prévues pour le contrôle interne
Le QIAcuity HEK293 resDNA Quant Kit détecte 5 fg d’ADN résiduel dans une seule réaction
| Quantité de chargement par réaction (fg/réaction) | HEK293 standard (copies/µl) | Contrôle interne (copies/µl)* |
|---|---|---|
| 50000 | 1104,9 | 96,6 |
| 5000 | 104,5 | 92,5 |
| 500 | 8,83 | 92,4 |
| 50 | 0,99 | 94,4 |
| NTC | 0 | 96,2 |
*100 copies/µl prévues pour le contrôle interne
Les kits fonctionnent avec le QIAcuity Digital PCR System et les QIAcuity Nanoplates, permettant ainsi une procédure de dPCR rapide et complète comparable à la qPCR, mais avec une quantification absolue de l’ADNres dans votre échantillon. Les kits ont été conçus selon les exigences de la production et du CQ du bioprocessus.
Principe
Vous trouverez ici une description du principe de la réaction de dPCR sur nanoplaque.
L’utilisation de la PCR numérique QIAcuity pour la surveillance de l’ADN de cellule hôte améliore la LoD/LoQ en fractionnant l’échantillon initial grâce à la QIAcuity Nanoplate 26k. Le fractionnement augmente la concentration effective de la cible, permettant ainsi de capturer et de mesurer une petite quantité d’ADN de cellule hôte avec une meilleure précision. La capacité à charger de grandes quantités de matrice dans la QIAcuity Nanoplate 26k associée à un nombre de partitions accru est l’une des raisons de cette précision plus élevée de la détection de cellule hôte résiduelle.
Procédure
Le lysat est ajouté au dosage quantitatif résiduel avec le contrôle interne et l’ADN de la cellule hôte mesuré par quantification absolue. Copies/µl est converti en fg/µl à l’aide d’un facteur de conversion fourni.
Applications
Les QIAcuity Residual DNA Quantification Kits sont parfaits pour la quantification hautement précise de l’ADN de cellule hôte dans les bioprocessus intermédiaires complexes.
Données et illustrations utiles
Seul un taux limité d’impuretés est autorisé dans la substance finale
Le transfert d’ADN de cellule hôte représente un risque, il est strictement encadré par les organismes de réglementation tels que la FDA et l’OMS