✓ Traitement automatique des commandes en ligne 24 h/24 7 j/7
✓ Assistance technique et produits pertinente et professionnelle
✓ Commande (ou réapprovisionnement) rapide et fiable
QIAEX II Gel Extraction Kit (150)
Cat. No. / ID: 20021
✓ Traitement automatique des commandes en ligne 24 h/24 7 j/7
✓ Assistance technique et produits pertinente et professionnelle
✓ Commande (ou réapprovisionnement) rapide et fiable
Caractéristiques
- Extraction performante d’ADN à partir de 40 pb à 50 kb
- Extraction sur gel à partir de gels d’agarose TAE ou TBE et de gels de polyacrylamide
- Pas d’iodure de sodium perturbant les réactions suivantes
- Pas de cisaillage de gros fragments d’ADN
Détails produit
Le système QIAEX II contient une suspension de particules de silice à laquelle se lient les fragments d’ADN en présence de sels chaotropiques. La suspension QIAEX II est ajoutée à des solutions ou des plaques de gel d’agarose solubilisé et se lie à l’ADN. Les particules sont collectées par une brève centrifugation et lavées puis un ADN de 40 pb à 50 kb est élué dans un tampon Tris ou de l’eau.
Performances
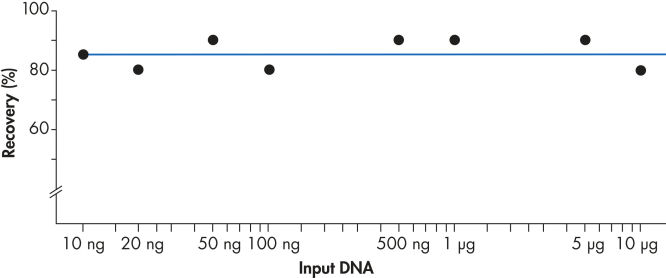
Avec le système QIAEX II, vous pouvez récupérer sans difficulté 10 ng à 10 µg d’ADN (voir l’illustration « Une récupération homogène »). La procédure polyvalente de purification par lof de fragments de gel peut facilement être adaptée à une capacité de liaison de 15 µg grâce à 30 µl de suspension QIAEX II.
Le système QIAEX II contient des particules de silice destinées à la purification de 60 à 95 % des fragments d’ADN (40 pb à 50 kb). Un volume de suspension QIAEX II de 10 µl peut se lier à 5 µg d’ADN, qui sont ensuite élués dans 20 µl.
Récupération selon la taille
| Taille d’ADN | Récupération, en pourcentage* |
|---|---|
| 44 pb | 75 |
| 75 pb | 75 |
| 500 pb | 95 |
| 7,5 kb | 85 |
| 23,5 kb | 75 |
| 48,5 kb | 60 |
Voir les illustrations
Principe
La purification des fragments d’ADN avec le système QIAEX II est basée sur la solubilisation de l’agarose et l’adsorption sélective des acides nucléiques sur les particules de gel de silice QIAEX II en présence de sels chaotropiques. Le QIAEX II sépare l’ADN des sels, de l’agarose, du polyacrylamide, des colorants, des protéines et des nucléotides sans extraction au phénol ni précipitation à l’éthanol. Le QIAEX II est efficace pour tout type d’agarose dans des tampons TAE ou TBE.
Les particules du QIAEX II donnent une bouillie destinée à l’extraction sur gel et assurent une bonne récupération sans cisaillage, même pour les gros fragments d’ADN. Des tampons optimisés permettent de récupérer l’ADN sans iodure de sodium, qui est difficile à éliminer des échantillons d’ADN et peut avoir une incidence sur les réactions suivantes.
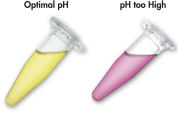
Le tampon de solubilisation et de liaison utilisé avec le système QIAEX II contient un indicateur de pH unique. Un simple changement de couleur indique si le pH du mélange de liaison est optimal pour une adsorption efficace de l’ADN sur les particules de silice du QIAEX II (voir l’illustration « Colorant indicateur de pH »). Le colorant marqué permet aussi de mieux visualiser l’agarose non solubilisé dans le mélange de liaison, cela garantit une solubilisation complète pour un rendement maximal.
Le colorant indicateur de pH dans le tampon de solubilisation et de liaison facilite la détermination visuelle du pH optimal pour l’adsorption de l’ADN (pH ≤ 7,5). Vous risquez d’obtenir un pH incorrect du mélange de liaison si le tampon de l’électrophorèse sur gel d’agarose a été utilisé fréquemment ou préparé de façon incorrecte. Dans ce cas, vous pouvez ajuster le pH sans problème par l’ajout de 10 µl d’acétate de sodium 3 M, pH 5,0.
Voir les illustrations
Procédure
Les particules de gel de silice QIAEX II sont ajoutées à la plaque de gel solubilisé puis les particules sont collectées par une brève étape de centrifugation (voir le schéma « Procédure QIAEX II »). Après le lavage, le fragment d’ADN pur est élué dans 20 µl de tampon Tris ou d’eau.
Le système QIAEX II contient une suspension QIAEX II, des tampons de liaison et de lavage et un manuel complet. Les protocoles sont proposés pour la purification d’ADN à partir de gels d’agarose, de solutions et de gels de polyacrylamide.
Voir les illustrations
Applications
L’ADN purifié à l’aide du système QIAEX II peut être utilisé directement dans la plupart des applications, notamment :
- Digestion par enzymes de restriction
- Marquage
- Ligature
- PCR
| Caractéristiques | Spécifications |
|---|---|
| Capacité de liaison | 5 µg/10 µl |
| Volume d’élution | 20 µl |
| Format | Tube |
| Taille du fragment | 40 pb – 50 kb |
| Traitement | Manuel |
| Récupération : oligonucléotides ADNdb | Récupération : fragments d’ADNdb |
| Élimination < 10 mères 17 à 40 mères de protéines de terminateurs colorés | Élimination < 40 mères |
| Type d’échantillon : applications | ADN : réactions de PCR |
| Technologie | Technologie à base de silice |
Données et illustrations utiles
Une récupération homogène.