Caractéristiques
- Conforme à la directive européenne IVD 98/79/CE
- Résultats complets en temps-réel
- Quantification précise de mutations du gène EGFR
- Interprétation aisée des informations de séquences complexes
Détails produit
Performances
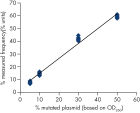
Linéarité
La linéarité a été déterminée à l’aide de mélanges de plasmides porteurs de la séquence sauvage ou mutante pour les mutations GGC-> AGC au niveau du codon 719, ACG-> ATG au niveau du codon 790 et CTG-> CGG au niveau du codon 858 et pour les délétions 2235del15 et 2236del15 au niveau de l’exon 19 (voir figure « Linéarité de la délétion 2235del15 »). Les plasmides ont été mélangés dans des proportions permettant d’obtenir quatre niveaux de mutation (5, 10, 30 et 50 %). Chaque mélange a été analysé avec trois lots différents du kit therascreen EGFR Pyro, lors de trois analyses de pyroséquençage portant chacune sur trois réplicats. (1)
Les résultats étaient linéaires, avec une non-linéarité autorisée de 5 unités de % dans l’intervalle testé de 5 à 50 % de niveau de mutation. Des résultats similaires ont été obtenus pour les mutations GGC-> AGC au niveau du codon 719, ACG-> ATG au niveau du codon 790 et CTG-> CGG au niveau du codon 858 et pour la délétion 2236del15 au niveau de l’exon 19. (1)
Précision
Les données de précision permettent de déterminer la variabilité totale des tests. Elles ont été obtenues pour trois niveaux différents, par analyse des mélanges de plasmides susmentionnés, avec trois réplicats chacun. (1)
La répétabilité (variabilité intra-test et inter-lot) a été calculée sur la base des données utilisées pour déterminer la linéarité (trois analyses réalisées le même jour avec divers lots du kit therascreen EGFR Pyro). La précision moyenne (variabilité intra-laboratoire) a été déterminée lors de trois analyses réalisées dans un seul laboratoire, trois jours différents, par des opérateurs, sur des systèmes PyroMark Q24 et avec des lots du kit therascreen EGFR Pyro variables. La reproductibilité (variabilité inter-laboratoire) a été calculée à partir de deux analyses réalisées chacune dans un laboratoire interne et dans un laboratoire externe, avec divers lots du kit therascreen EGFR Pyro. (1)
Les estimations de la précision sont exprimées en tant qu’écart-type des fréquences de mutation mesurées, en unités de %. La répétabilité, la précision moyenne et la reproductibilité de la délétion 2235del15 au niveau de l’exon 19 étaient respectivement de 0,8–1,2, 0,7–2,9 et 0,7–1,8 unités de %, dans les limites mesurées d’un niveau de mutation compris entre 5 et 50 %. Des résultats similaires ont été obtenus pour les mutations GGC-> AGC au niveau du codon 719, ACG-> ATG au niveau du codon 790 et CTG-> CGG au niveau du codon 858 et pour la délétion 2236del15 au niveau de l’exon 19. (1)
| % de plasmides mutés | Répétabilité (moyenne ; É.T.) | Précision moyenne (moyenne ; É.T.) | Reproductibilité (moyenne ; É.T.) |
|---|---|---|---|
| 5 | 7,7 ; 0,8 | 7,4 ; 0,7 | 7,4 ; 0,7 |
| 10 | 14,7 ; 1,1 | 14,5 ; 1,3 | 14,4 ; 1,1 |
| 30 | 41,8 ; 1,2 | 40,0 ; 2,0 | 41,5 ; 1,7 |
| 50 | 59,4 ; 1,0 | 58,2 ; 2,9 | 60,7 ; 1,8 |
Principe
Le kit therascreen EGFR Pyro est utilisé pour les mesures quantitatives de mutations des codons 719, 768, 790, 858 et 861, ainsi que pour les délétions et mutations complexes de l’exon 19 du gène EGFR humain en temps réel, à l’aide de la technologie de pyroséquençage sur le système PyroMark Q24. Le gène EGFR encode la protéine du récepteur de facteur de croissance épidermique (EGFR). Des mutations dans le domaine tyrosine kinase du gène EGFR peuvent permettre la croissance et la progression tumorales. Les mutations EGFR sont présentes dans environ 10 % des incidences du cancer du poumon non à petites cellules aux États-Unis et 35 % en Asie de l’Est. En outre, les mutations EGFR sont présentes dans 6 % de tumeurs cérébrales. (1)
Les mutations suivantes sont détectées :
- Exon 18 (719) : G719A, G719C, G719S
- Exon 19 (dél.) : 20 délétions et mutations complexes
- Exon 20 (768 et 790) : S768I, T790M
- Exon 21 (858-861) : L858R, L861Q, L861R
Les mutations supplémentaires peuvent être détectées et analysées manuellement. (1)
Procédure
Après l’utilisation des amorces PCR ciblant les exons 18, 19, 20 et 21, les amplicons sont immobilisés sur des billes de sépharose recouvertes de streptavidine (Streptavidin Sepharose High Performance). L’ADN simple brin est préparé et les amorces de séquence correspondantes s’hybrident avec l’ADN. Les échantillons sont ensuite analysés sur le système PyroMark Q24 à l’aide de fichiers de configuration du test et d’un fichier de configuration d’analyse. (1)
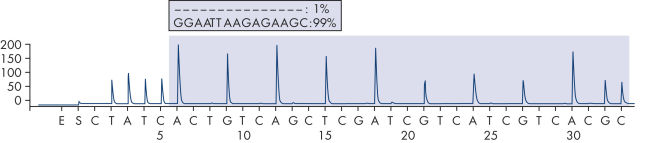
Il est recommandé d’utiliser l’EGFR Plug-in Report pour analyser le test. Ce rapport permet de s’assurer que les bonnes LoD sont utilisées et que les différentes séquences à analyser sont automatiquement utilisées pour la détection de toutes les mutations et délétions. Toutefois, le test peut également être analysé à l’aide de l’outil d’analyse intégré au système PyroMark Q24 (voir figures « Tracé de pyrogramme d’un génotype normal au niveau du codon 719 », « Tracé de pyrogramme d’un génotype normal au niveau du codon 768 », "Tracé de pyrogramme d’un génotype normal au niveau de l’exon 19 » et « Tracé de pyrogramme d’une délétion 2235del15 au niveau de l’exon 19 »). La « Sequence to Analyze » (séquence à analyser) peut alors être adaptée pour la détection de différentes délétions au niveau de l’exon 19 et de mutations rares au niveau des autres exons après le test. (1)
Applications
Le kit therascreen EGFR Pyro permet de procéder à la détection et à la mesure quantitative des mutations au niveau des codons 719, 768, 790 et 858 à 861, ainsi que des délétions et mutations complexes au niveau de l’exon 19 du gène EGFR humain. Ce kit a été conçu pour faciliter l’identification des patients atteints de cancer les plus à même de bénéficier d’un traitement par inhibiteur de tyrosine kinase. (1)
Les mutations suivantes sont détectées :
- Exon 18 (719) : G719A, G719C, G719S
- Exon 19 (dél.) : 20 délétions et mutations complexes
- Exon 20 (768 et 790) : S768I, T790M
- Exon 21 (858-861) : L858R, L861Q, L861R
Les mutations supplémentaires peuvent être détectées et analysées manuellement. (1)
Données et illustrations utiles
Pyrogram trace of a normal genotype in exon 19.