✓ Traitement automatique des commandes en ligne 24 h/24 7 j/7
✓ Assistance technique et produits pertinente et professionnelle
✓ Commande (ou réapprovisionnement) rapide et fiable
QuantiTect Virus Kit (1000)
Cat. No. / ID: 211015
✓ Traitement automatique des commandes en ligne 24 h/24 7 j/7
✓ Assistance technique et produits pertinente et professionnelle
✓ Commande (ou réapprovisionnement) rapide et fiable
Caractéristiques
- Haute sensibilité dans les dosages simples et multiplexes
- Détection de l’ARN et/ou de l’ADN viral dans la même réaction
- Détection claire des signaux positifs faibles
- Protocoles universels rapides en 2 étapes
- 5x mélanges principaux pour une plus grande sensibilité avec plus d’échantillons
Détails produit
Performances
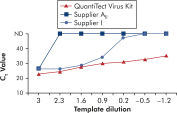
L’amplification à l’aide des QuantiTect Virus Kits permet d’obtenir des courbes sigmoïdales raides sur une plage de dilutions, même pour de faibles quantités de matrice avec des valeurs CT élevées (voir figure « Détermination sans ambiguïté des valeurs de CT sur une large plage dynamique »). Cela permet de déterminer avec précision la valeur CT pour la quantification des acides nucléiques viraux dans la PCR en temps réel.
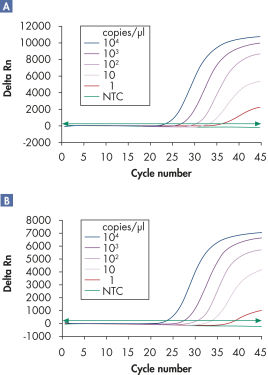
Les dosages multiplex permettent de détecter plusieurs cibles d’ARN et/ou d’ADN viral ainsi que des contrôles internes sur une large plage linéaire sans perte de sensibilité (voir les figures « Détection fiable de l’ARN viral sur une large plage linéaire » et « Amélioration de la détection de faibles quantités d’ARN viral »).
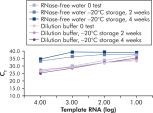
Le QuantiTect Nucleic Acid Dilution Buffer, fourni avec les kits, stabilise les étalons d’ARN et d’ADN pendant la dilution et la configuration de la réaction et empêche la perte d’acides nucléiques sur les surfaces en plastique, telles que les tubes ou les pointes de pipette. Le tampon permet une dilution fiable des étalons utilisés pour quantifier les acides nucléiques viraux, donnant une large plage linéaire, de valeurs CT faibles à élevées, et assure un stockage plus long des étalons sans dégradation (voir figure « Dilution et stockage fiables des étalons d’ARN »).
Voir les illustrations
Principe
Les QuantiTect Virus Kits permettent une détection très sensible des acides nucléiques viraux dans les dosages simples ou multiplex dès le premier essai (voir l’organigramme « Kits multiplex QIAGEN »). Le mélange principal optimisé garantit que les produits PCR dans une réaction multiplex sont amplifiés avec la même efficacité et la même sensibilité que les produits PCR dans une réaction d’amplification simple correspondante.
L’amplification des gènes de contrôle et des gènes cibles dans la même réaction plutôt que dans des réactions séparées augmente la fiabilité de la quantification des gènes en minimisant les erreurs de manipulation. Le QuantiTect Virus Buffer contient une combinaison équilibrée d’ions K+ et NH4+ ainsi que le Factor MP synthétique unique stabilisants qui, ensemble, favorisent une renaturation stable et efficace des amorces et des sondes sur la matrice d’acide nucléique, ce qui permet une grande efficacité de la PCR (voir figure « Tampon PCR unique »). En outre, la formulation unique de la Sensiscript Reverse Transcriptase garantit une transcription inverse très sensible de l’ARN viral, tandis que la HotStarTaqPlus DNA Polymerase assure un hot start rigoureux, empêchant la formation de produits non spécifiques.
| Composant du kit | Caractéristique | Avantages | |
|---|---|---|---|
| 5x QuantiTect Virus Master Mix | Mélange principal concentré | Hautement concentré et optimisé pour une détection sensible des virus | Pour augmenter la sensibilité du dosage, il est possible d’ajouter des volumes plus importants de matrice |
| HotStarTaq Plus DNA Polymerase | 5 min d’activation à 95 °C | Réglage des réactions qPCR à température ambiante | |
| QuantiTect Virus Buffer | Combinaison équilibrée d’ions NH4+ et K+ | La renaturation spécifique des amorces garantit des résultats fiables de la PCR | |
| Synthetic Factor MP | Analyse multiplexe fiable d’un maximum de 4 gènes dans le même tube | ||
| Composants supplémentaires du kit | QuantiTect Virus RT Mix | Contient une formulation unique de Sensiscript Reverse Transcriptase | Optimisé pour une détection très sensible de l’ARN viral |
| QuantiTect Nucleic Acid Dilution Buffer | Formule tampon exclusive pour la dilution et le stockage des étalons d’acides nucléiques. | Stabilise les étalons d’ARN et d’ADN pendant la dilution et la configuration de la réaction et empêche la perte d’acides nucléiques sur les surfaces en plastique, telles que les tubes ou les pointes de pipette |
Voir les illustrations
Procédure
Les QuantiTect Virus Kits permettent une analyse de PCR en temps réel très sensible des acides nucléiques viraux (ARN et/ou ADN) et des contrôles internes à l’aide de sondes spécifiques à une séquence. Les réactions peuvent être effectuées avec ou sans étape de transcription inverse, ce qui permet de concevoir avec souplesse des dosages multiplex pour détecter des cibles d’ARN, des cibles d’ADN ou des cibles d’ARN et d’ADN. Suivez le protocole du manuel pour obtenir des résultats rapides et fiables.
Les kits sont disponibles avec ou sans colorant de référence passif ROX dans le mélange principal (voir tableau).
| Colorant ROX | Kit | Thermocycleurs compatibles |
|---|---|---|
| Fourni dans le mélange principal | QuantiTect Virus Kit | Tous les thermocylceurs d’Applied Biosystems sauf Applied Biosystems 7500 |
| Fourni dans un tube séparé | QuantiTect Virus +ROX Vial Kit | Applied Biosystems 7500 et thermocycleurs de Bio-Rad, Cepheid, Eppendorf, QIAGEN, Roche, Agilent et d’autres fournisseurs |
Pour les applications RT-PCR en une étape, rapides et très sensibles, y compris la détection de virus, nous recommandons d’utiliser le QIAGEN OneStep RT-PCR Kit.
Applications
Données et illustrations utiles
Détermination sans ambiguïté des valeurs de CT sur une large plage dynamique.
Specifications
| Features | Specifications |
|---|---|
| Applications | Détection de virus |
| SYBR Green I or sequence-specific probes | Sondes spécifiques à une séquence |
| Real-time or endpoint | Temps réel |
| Reaction type | Transcription inverse et PCR |
| Thermal cycler | La plupart des thermocycleurs en temps réel (à l’exception des thermocycleurs capillaires, par exemple LightCycler® 1.x et 2.0) |
| Sample/target type | Cibles ARN et/ou ADN |
| With or without ROX | Disponible avec ROX dans le mélange principal et ROX en flacon séparé |
| Single or multiplex | Simple ou multiplex |