✓ Procesamiento automático sin interrupción de pedidos en línea
✓ Servicio técnico y para productos experto y profesional
✓ Realización y repetición de pedidos rápidas y fiables
QuantiTect Virus Kit (1000)
Cat. No. / ID: 211015
✓ Procesamiento automático sin interrupción de pedidos en línea
✓ Servicio técnico y para productos experto y profesional
✓ Realización y repetición de pedidos rápidas y fiables
Características
- Gran sensibilidad en ensayos simples y múltiples
- Detección de ARN y/o ADN vírico en la misma reacción
- Detección clara de señales positivas débiles
- Protocolos universales y rápidos de dos pasos
- Mezcla maestra quíntuple para mayor sensibilidad con más entrada de muestra
Detalles del producto
Rendimiento
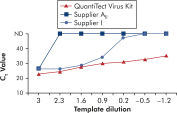
La amplificación con los QuantiTect Virus Kits proporciona curvas sigmoides pronunciadas en un rango de diluciones, incluso para las bajas cantidades de molde con valores de CT altos (consulte la figura “ Determinación inequívoca de los valores de CT en un amplio rango dinámico”). Esto permite la determinación exacta de los valores de CT para la cuantificación de ácidos nucleicos víricos en la real-time PCR.
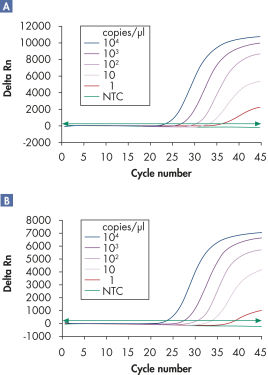
Los ensayos múltiples permiten la detección de varias dianas de ARN y/o ADN vírico más controles internos en un amplio rango lineal sin pérdida de sensibilidad “ Detección fiable del ARN vírico en un amplio rango lineal” y “ Detección mejorada de cantidades bajas de ARN vírico”).
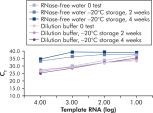
El QuantiTect Nucleic Acid Dilution Buffer, suministrado con los kits, estabiliza los patrones de ARN y ADN durante la preparación de la reacción y la dilución y previene la pérdida de ácidos nucleicos en las superficies de plástico, como tubos o puntas de pipetas. El tampón permite la dilución fiable de patrones utilizados para cuantificar ácidos nucleicos víricos, lo que ofrece un rango lineal más amplio, desde valores de CT bajos a altos y garantiza el almacenamiento más prolongado de los patrones sin degradación (consulte la figura “ Almacenamiento y dilución fiables de patrones de ARN”).
Ver figuras
Principio
Los QuantiTect Virus Kits permiten la detección muy sensible de ácidos nucleicos víricos en ensayos simples o múltiples en el primer intento (consulte el diagrama de flujo “ Kits de análisis múltiple de QIAGEN ”). La mezcla maestra optimizada garantiza que los productos de PCR de una reacción múltiple se amplifiquen con la misma eficacia y sensibilidad que los productos de PCR en la reacción de amplificación simple correspondiente.
La amplificación de genes diana y de control en la misma reacción, en lugar de en reacciones independientes, aumenta la fiabilidad de la cuantificación genética al reducir al mínimo los errores de manipulación. El QuantiTect Virus Buffer contiene una combinación equilibrada de iones de K+ y NH4+, así como estabiliza el exclusivo Factor MP sintético, que juntos favorecen la hibridación estable y eficaz de cebadores y sondas al molde de ácido nucleico, lo que resulta en una alta eficacia de la PCR (consulte la figura “ Tampón de PCR exclusivo”). Además, la exclusiva formulación de la Sensiscript Reverse Transcriptase garantiza la transcripción inversa muy sensible del ARN vírico, mientras que la HotStarTaq Plus DNA Polymerase proporciona un riguroso hot start, lo que impide la formación de productos no específicos.
| Componente del kit | Característica | Beneficios | |
|---|---|---|---|
| 5x QuantiTect Virus Master Mix | Mezcla maestra concentrada | Muy concentrada y optimizada para la detección sensible de virus | Se pueden añadir volúmenes mayores de molde al ensayo para aumentar la sensibilidad |
| HotStarTaq Plus DNA Polymerase | Activación de 5 min a 95 ºC | Preparación de reacciones de qPCR a temperatura ambiente | |
| QuantiTect Virus Buffer | Combinación equilibrada de iones de NH4+ y K+ | La hibridación de cebadores específicos garantiza la fiabilidad de los resultados de la PCR | |
| Factor MP sintético | Análisis múltiple fiable de hasta 4 genes en el mismo tubo | ||
| Componentes adicionales del kit | QuantiTect Virus RT Mix | Contiene una exclusiva formulación de Sensiscript Reverse Transcriptase | Optimizado para la detección muy sensible de ARN vírico |
| QuantiTect Nucleic Acid Dilution Buffer | Formulación de tampón patentada para la dilución y el almacenamiento de patrones de ácido nucleico. | Estabiliza los patrones de ADN y ARN durante la preparación de la reacción y dilución y previene la pérdida de ácidos nucleicos en las superficies de plástico, como tubos o puntas de pipetas |
Ver figuras
Procedimiento
Los QuantiTect Virus Kits ofrecen un análisis por real-time PCR muy sensible de ácidos nucleicos víricos (ARN y/o ADN) y controles internos utilizando sondas específicas de secuencia. Las reacciones se pueden llevar a cabo con o sin un paso de transcripción inversa, lo que permite el diseño flexible de ensayos múltiples para detectar dianas de ARN, dianas de ADN o dianas de ARN y ADN. Siga el protocolo del manual de uso para obtener resultados rápidos y fiables.
Los kits están disponibles con o sin colorante de referencia pasivo ROX en la mezcla maestra (consulte la tabla).
| Colorante ROX | Kit | Termocicladores compatibles |
|---|---|---|
| Se suministra en la mezcla maestra | QuantiTect Virus Kit | Todos los termocicladores de Applied Biosystems, excepto Applied Biosystems 7500 |
| Se suministra en un tubo separado | QuantiTect Virus +ROX Vial Kit | Applied Biosystems 7500 y termocicladores de Bio-Rad, Cepheid, Eppendorf, QIAGEN, Roche, Agilent y otros proveedores |
Para las aplicaciones de RT-PCR de un paso de punto final, rápida y muy sensible, incluida la detección de virus, recomendamos utilizar el QIAGEN OneStep RT-PCR Kit.
Aplicaciones
Datos y cifras de respaldo
Determinación inequívoca de los valores de CT en un amplio rango dinámico.
Specifications
| Features | Specifications |
|---|---|
| Applications | Detección de virus |
| SYBR Green I or sequence-specific probes | Sondas específicas de secuencia |
| Real-time or endpoint | En tiempo real |
| Reaction type | Transcripción inversa y PCR |
| Thermal cycler | La mayoría de los termocicladores en tiempo real (excepto los termocicladores capilares; p. ej., LightCycler® 1.x y 2.0) |
| Sample/target type | Dianas de ARN y/o ADN |
| With or without ROX | Disponibles con ROX en la mezcla maestra y con ROX en un vial separado |
| Single or multiplex | Único o múltiple |